手首からの光電式容積脈波記録信号に基づく脈拍数変動解析のための高信頼性の心拍検出アルゴリズム
要約
心臓の自律神経機能を評価するためには、心電図(ECG)を用いて心拍変動(HRV)を測定するのが一般的な診断方法ですが、心機能を評価するより便利な手法として、光電式容積脈波記録法(PPG)による波形を使用するやり方があります。この手法では、HRVの代わりに脈拍数変動(PRV)が使用されます。しかし、PPG信号用の信頼性の高い検出アルゴリズムがなかったことから、医療の市場においてPRVによる臨床診断は実現することなく、睡眠段階、ストレス状態、疲労などのウェルネスを目的とした生体情報を測定する上での障害となっていました。
本稿では、PPG信号を使用した心拍パルス間隔解析のための、信頼性の高いピークおよびオンセット検出アルゴリズムについて説明します。ここでは、複数のセンサーを内蔵したアナログ・デバイセズ(ADI)のウォッチ・プラットフォームを使った大量のデータ収集により、これを実現する方法を示します。このプラットフォームは、ECG信号から得られた心拍結果に比べ、網羅率が大きい上に感度が高く、連続した心拍間隔値の差の二乗平均平方根(RMSSD)が小さいという特性を備えています。
はじめに
心拍数(HR)モニタリングは、既存の多くのウェアラブル・デバイスや臨床デバイスの重要な機能ですが、これらのデバイスは、心拍パルス間隔を使用して連続的な心拍数変動を測定する機能をまだ備えていません。HRVは、心電図(ECG)から取り出された連続する2つの心拍間の時間間隔(心拍間隔と呼ばれる)の変化で構成されます1。HRVには、自律神経系の交感神経活動と副交感神経活動を反映するよく知られた情報が含まれています2。研究者は臨床診断を支援するためのツールとして、また、睡眠段階、ストレス状態、疲労などのウェルネスを目的とした生体情報を測定するためのツールとして、HRVを広く利用してきました2,3。しかしECG測定の技術条件を考えると、事故や災害の現場、戦場、あるいはECGが電気的干渉を引き起こす可能性のある場所などでは、この信号を使用できない場合もあります4。
光電式容積脈波記録法(PPG)による信号から取り出した脈拍数変動は、HRVの代わりに使用することができます5,6,7。PPG信号は、LEDを使って人間の皮膚に光を当て、血流のために生じる反射光の強さの変化をフォトダイオードで測定することによって得られます。.
更にPPGでは、心拍数、動脈圧、血管硬化指数、脈波伝播時間、脈波伝播速度、心拍出量、動脈コンプライアンス、抹消抵抗といった心臓血管系の関連情報を得ることができます8,9,10。しかし、PPGベースのアルゴリズムの性能は、血液還流の低下、周囲光、モーション・アーチファクト(MA)によって低下する可能性があり、この中で最も重要なのがMAです11。これまで、PPGセンサーの近くに配置した3軸加速度センサーを使用してMAノイズを除去する信号処理手法が、アナログ・デバイセズのモーション除去および周波数トラッキング・アルゴリズムを含め、数々提案されてきました。
PRV解析のためには、PPG波形から収縮期ピーク値、オンセット、ディクロティック・ノッチなどの重要なポイントを正確に取り出すことが重要です12。PPG波形のオンセットは心臓から大動脈への血液の送出によるもので、ディクロティック・ノッチは血液送出の終了、つまり大動脈弁の閉鎖によるものです。PPG信号用の信頼性の高い検出アルゴリズムがないことが、多少なりともPPGによるPRV解析実施の妨げとなっていました。PRVに関する過去の取り組みには、基準点を無視しているものや13、収集期のピーク値の検出を手動や経験的な方法で行っていたものがありました14。更に、妥当性が確認されていない時間ウィンドウベースのアルゴリズムに基づいて、パルス・ピーク値を取得する例もありました15。
本稿では、本来、動脈圧(ABP)波形用に提案された予測法を利用した、信頼性の高いピークおよびオンセット検出アルゴリズムを提案します16。手首装着式のウェアラブル・デバイスを使用するPPG信号には、多くのモーション・アーチファクト、ベースライン変動、反射波、検出アルゴリズムの挙動に影響を与え得るその他のノイズが含まれている点に留意する必要があります6。したがって、データは前処理されてから心拍抽出モデルへ送られます。この作業に使用する自動予測モデルは、未加工のPPGデータから得られた様々な前処理信号が使われる複合的アプローチで、ピークとオンセットの取り出しにはこれらの信号の1次導関数が使われます。ここでは、同期されたPPG信号とECG信号を提供するアナログ・デバイセズのウォッチ・プラットフォームを使ってデータを収集した大規模データベースを使用します。このアルゴリズムはメモリ・フットプリントに関しては軽量で、アナログ・デバイセズのウォッチ・プラットフォームの組み込みアルゴリズムとして使用することができます。このアルゴリズムの妥当性確認と比較は、網羅率、感度、陽性的中率、および連続した心拍間隔の差の二乗平均平方根を使い、ECG信号から得られた心拍測定結果に対して行われます17。
PPG形態に基づく心拍アルゴリズム
この項では、手首のPPG信号用に提案する心拍アルゴリズムの詳細を説明します。このアルゴリズムは、(i)前処理モジュールと、(ii)高分解能の心拍抽出モジュールで構成されます。このアルゴリズムのブロック図を図1に示します。

前処理
PPG信号が、周辺組織の血液還流の低下やモーション・アーチファクトの影響を受けやすいことはよく知られています18。その後行われる心拍予測向けのPPG解析段階でこれらの要素の影響を最小限に抑えるには、前処理段階が必要です。このステップは以下の処理で構成されます。
- フレームとウィンドウの設定
- バンドパス・フィルタ処理(0.4Hz~4Hz)
- 信号レベルを制限するための自動ゲイン制御(AGC)
- 信号の平滑化とベースライン変動の除去
PPG入力データはT0秒のウィンドウを使って処理され、その後のブロックはmT0(この場合はm = 3/4)のオーバーラップでウィンドウを移動させることによって処理されます。更にバンドパス・フィルタで、PPG信号の高周波成分(電源など)と、毛細血管密度や静脈血量の変化、温度変動といった低周波成分の両方を除去する必要があります。フィルタリング前後のPPG信号を図2aと図2bに示します。フィルタのカットオフ周波数は0.4Hzと4Hz、HRの基本周波数範囲は0.4Hz~3Hzです。したがって、心拍数を推定するためにわずかに高い範囲を使用すれば、心拍時間を強調する高調波を含めることができます。フィルタ処理した信号のスパイクは、メジアン・フィルタを使って除去します。次に、後の段階で信号振幅をチェックすることによって選択ピークを検証するために、AGCモジュールが信号レベルを±Vボルトに制限します。HRVを得るための永続的なPPG測定プロセスでは、ベースライン変動のような別のタイプのアーチファクト発生は避けられません。結果として、ローパス有限インパルス応答(FIR)フィルタを使用して、フレーム内にあるPPGサンプルの配列を平滑化し(図2c参照)、ベースライン変動ノイズを除去して予測モジュール用の信号をよりスムーズなものにします。

高分解能の心拍抽出モジュール
心拍抽出アルゴリズムは、以下のモジュールで構成されています。
- 補間
- 予測
- 高分解能心拍抽出
- 信号品質基準
前処理モジュールの出力は、心拍抽出アルゴリズムの精度を上げるために補間ブロックに送られます。t0からtTまでのPPGセグメントが、心拍間隔b0とbTの最初のフレーム内で与えられた場合は、端点間のn個の点を使って心拍間隔値を直線補間し、b0とbTから高分解能の心拍間隔(例えば1ms分解能)を取り出します。次に予測モジュールが、信号形態と律動情報の両方に依存してピークとオンセットを取り出します。したがって、心拍を検出するには収縮期ピーク値が必要なだけでなく、オンセットとディクロティック・ノッチもレポートする必要があります。提案された予測モデルは、理論的にはAn Adaptive Delineator for Photoplethysmography Waveforms(光電式容積脈波記録波形用の適応型予測モデル)12およびOn an Automatic Delineator for Arterial Blood Pressure Waveforms(動脈血圧波形用の自動予測モデルについて)16に示すものと同じであり、信号の1次導関数から得られる変曲点とゼロ交差点のペアを使用することによって、手首のPPG信号に適用されます。図2dは、PPG特性評価のために変曲点とゼロ交差点の両方をプロットしたものです。ゼロ交差点に関しては、初期条件を合わせることによって開始時と終了時の過渡を最小限に抑える、ゼロ位相歪みフィルタを使って信号処理が行われます。これは、フィルタ処理後も時間領域の特徴を維持できるようにするためです。PPG波形の導関数から得られるオンセットは最大変曲点前のゼロ交差点に対応し、収縮期ピーク値はその変曲点後のゼロ交差点に関係しています。この心拍アルゴリズムに使われる信号品質基準は明瞭さであり、信号がトーンを持つ程度を示します。この基準は元々Philip McLeodとGeoff Wyvillの記事、A Smarter Way to Find Pitch(よりスマートなピッチ検出法)19の中で提案されたもので、この記事では正規化された二乗誤差関数(自己相関関数の一形態)を使って信号の周期性を割り出しています。ここでは、この指標を使って、心拍アルゴリズムによりどの時点で信頼できるピークとオンセットをレポートするかを決定します。
アナログ・デバイセズの手首装着型プラットフォームの評価結果
ここで提案したPPG心拍アルゴリズムによる結果を、ECGピーク検出用アルゴリズムとして広く知られているPan-Tompkinsアルゴリズム20による結果と比較しました。データは、提案アルゴリズムを判定するために、アナログ・デバイセズのバイタル・サイン・モニタリング(VSM)リスト・ウォッチ・プラットフォーム(腕時計型プラットフォーム)を使って収集しました。Bluetooth®接続を介してこのウォッチとインターフェースをとるにあたっては、アナログ・デバイセズのVSM iOSアプリケーションを使用しました。アナログ・デバイセズのリスト・ウォッチでは、被験者の手首からPPG信号を収集するためのPPGセンサーが組み込まれています。アナログ・デバイセズのリスト・ウォッチにはECG信号も収集されます。3つのECG電極を被験者の胸部に取り付けました。これらの電極からのワイヤをアナログ・デバイセズのリスト・ウォッチに接続し、そこで信号を処理してPPG信号と同時に記録します。つまり、このプラットフォームは同期されたPPG信号とECG信号を提供します。データ収集に使用したアナログ・デバイセズのリスト・ウォッチを図3aに、iOSアプリのインターフェースとプラットフォームから得られたサンプル信号を図3bに示します。

判定指標と結果
心拍指標を計算する前に、Pan-Tompkinsアルゴリズム出力やPPG心拍アルゴリズム出力の欠落ピークや余分なピークを識別する異常値除去プロセスを設けることが重要です。欠落ピークや余分なピークを無視すると心拍時間が異常な値となり、結果が不正確なものになってしまいます。ECG信号の欠落ピークや余分なピークは、Pan-Tompkinsアルゴリズムで提供される連続心拍時間に着目することよって識別し、20%を超える心拍時間変化をもたらすECGピークは、異常値と判定しました。これらのECGピークを除去した後に、各ECGピークとPPG信号内のピークを相関付けることによって、PPG信号内の欠落ピークや余分なピークを識別します。PPGピークとECGピークの相関付けは、そのPPGピークが時間的にECGピークの近傍にあるかどうかによって行いました。1つのECGピークの近傍にPPGピークを識別できない場合や、識別できるピークの数が多すぎる場合、それらは異常値として分類しました。これらの欠落/余分PPG心拍から生じる異常な心拍時間は、指標計算時には異常値として無視しています。
いくつかの指標が、提案アルゴリズムとPan-Tompkinsアルゴリズムによる心拍値を使って計算されます。これらの指標は、(i)網羅率(式1)、(ii)感度またはSe(式2)、(iii)陽性的中率またはP+(式3)、および(iv)連続した心拍間隔の差の二乗平均平方根またはRMSSD(式4)です。図4は、指標計算に使用するいくつかの値を視覚的に表したものです。

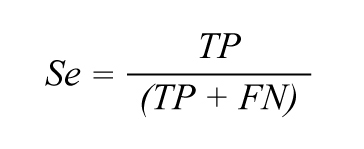
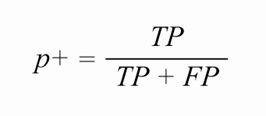


ここで、TP(True Positive:真陽性)はPPG B2Bアルゴリズムによって正しく識別された心拍の数、FP(False Positive:偽陽性)はECGによる実際の心拍に対応していないPPG心拍の数、FN(False Negative:偽陰性)はPPG心拍アルゴリズムによって捉えることができなかった心拍の数です。心拍間隔時間(IBI)は、連続する2つのECGピーク間、PPGピーク間、またはPPGオンセット間の時間です。
提案するアルゴリズムの判定を行うために、各被験者に関するPPG信号とECG信号を同時に収集しました。データは、年齢、皮膚の色合い、体形の異なる多数の被験者から収集しています。これは、判定結果があらゆる人々にあてはまるようにするためです。データは、27名の被験者(様々な皮膚の色合いを持つ男性と女性)から、それぞれ2分30秒にわたり収集しました。被験者には、測定時間の前半には立ってもらい、後半には座ってもらいました。心拍アルゴリズムの各指標の平均結果を表1に示します。この表に示すように、ECG信号による結果と比較した場合の手首データの網羅率、感度、および陽性的中率はすべて83%を超え、平均RMSSD差は20ms未満でした。
| 指標 | 結果 |
| 網羅率 | 83% |
| 感度 | 87% |
| 陽性的中率 | 98% |
| PPGとECGの平均RMSSD差 | 12 ms |
検討とまとめ
本稿では、手首からのPPG信号によるPRV解析のための信頼性の高いピークおよびオンセット検出アルゴリズムを提案しました。このアルゴリズムでは複数段の前処理を行い、手首から得たPPG信号の基準点を検出するための複合予測アルゴリズムを提案しました。この提案したアルゴリズムをテストするための判定用プラットフォームには、複数のセンサーを使用するアナログ・デバイセズのウォッチを使用しました。その結果はECG HRVとの強い相関性を示しており、結果もよく一致しています。今後の開発では、モーション除去アルゴリズムの適用と、PRV解析における欠落心拍に関する問題の取り扱いに重点を置く予定です。